Біомаркери аутизму.
Збільшення кількості діагностованих випадків порушень спектра аутизму (ASD) протягом останніх чотирьох десятиліть було досить значним. Останнім часом існує дискусія щодо основної патофізіології ASD. Відсутність певного біологічного розуміння патофізіології ASD означає, що діагнози базуються на поведінкових спостереженнях та психометричних інструментах. Однак інтеграція фізіологічних вимірювань в діагностику ASD може призвести до ранішої та точнішої діагностики, а і відповідно до кращих результатів лікування і корекції. Як ми розглядали в попередній статті (ось тут), наявність аутичних симптомів ще не значить, що в дитини аутизм. Тому дослідники шукаючи патофізіологічні підстави для таких проявів почали вивчати біохімічні зміни в організмі дітей з аутичними проявами.
Ця стаття написана на основі дослідження спрямованого на пошук біохімічних показників в діагностиці ASD шляхом аналізу концентрацій метаболітів фолат-залежного однокарбонового обміну та трансульфураційних шляхів у зразках крові 83 учасників з ASD та 76 нейротипових однолітків.
Розлади спектру аутизму (ASD) охоплюють велику групу неврологічних захворювань, що розвиваються на ранніх етапах, і характеризуються труднощами у соціальному спілкуванні/взаємодії та виявленням обмежених повторюваних поведінкових проявів та інтересів. Окрім цих визначальних поведінкових симптомів, особи з ASD часто мають один або декілька співіснуючих захворювань, включаючи інтелектуальну відсталість, синдром гіперактивності, затримку мовлення та мови, психіатричні діагнози, епілепсію, порушення сну та проблеми зі шлунково-кишковим трактом.
Загалом визнано, що аутичні розлади мають сильну генетичну складову, але вплив зовнішнього середовища виявився важливим фактором, що сприяє етіології та патофізіології ASD принаймні у певній частині випадків. Раніше дослідження з близнюками вказували на те, що спадковість ASD становила 80–90%; однак з 2010 року подібні дослідження вказують на менший зв’язок зі спадковістю, лише 37–55%. Незважаючи на цей високий генетичний зв’язок, лише 15% випадків ASD мають відоме генетичне джерело. І хоча появляються нові генетичні дослідження по вивченні етіології ASD, вплив факторів зовнішнього середовища, таких як токсичний хімічний вплив, різні інфекції матері тощо, також виявляються ключовими факторами, які сприяють ризику ASD.
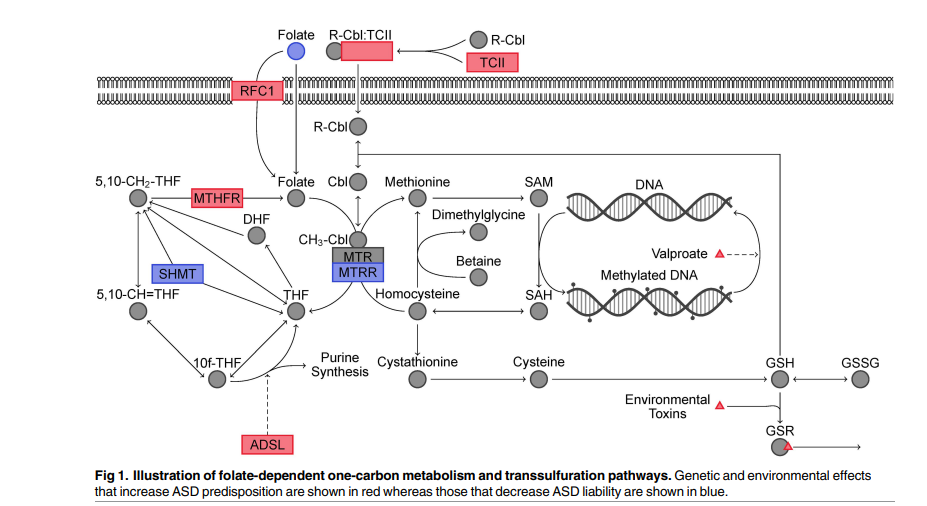
До цього моменту не існувало загальноприйнятих біомаркерів для діагностики або визначення важкості ASD. Замість цього діагностична оцінка включала мультидисциплінарний колектив лікарів, зазвичай включаючи педіатра, психолога, логопеда та профільного спеціаліста. Незважаючи на поточний стан справ, постійно тривала робота з пошуку біомаркерів, які могли би допомогти в процесі діагностики. Зокрема, виявлені аномалії в фолат-залежному однокарбоновому метаболізмі (ФОМ) та транссульфурації (ТС) ймовірно сприяють генетичній та середовищній схильності до ASD. ФОМ сприяє епігенетичному проявленню генів через метилювання ДНК, а ТС є основним впливом на внутрішньоклітинний окисно-відновний стан. Зображення цих шляхів ASD, наведена на мал. 1.

Мутації або змінені рівні експресії генів у цих шляхах були пов’язані зі збільшеним ризиком розвитку ASD. Недостатність аденілосукцинатліази (ADSL) приводить до чисто генетичної форми аутизму, перенаправляючи значну частину ФОМ в напрямок синтезу пуринів. Метилентетрагідрофолат-редуктаза (MTHFR) відповідає за утворення 5-метилтетрагідрофолату, який, в свою чергу, відповідає за реметилювання гомоцистеїну до метіоніну. Зокрема, поліморфізм C677T в багатьох дослідженнях був показаний як фактор, що збільшує ризик ASD, особливо в країнах, де добавка фолієвої кислоти в продукти низька. Обмежені докази зв’язку між мутаціями у зменшеному переносі фолієвої кислоти (RFC1), транскобаламіну II (TCII), серингідроксиметилтрансферазі І (SHMT1), 5-метилтетрагідрофолат-гомоцистеїнметилтрансферазі-редуктазі (MTRR) та катехол-O-метилтрансферазі (COMT) зі зміненим розповсюдженням ASD також були представлені, хоча ці внески в ризик ASD наразі ще обговорюються.
Певний зв’язок між впливом різних факторів зовнішнього середовища на ФОМ/ТС та схильністю до ASD можна побачити на прикладі вальпроату (депакіну) та токсичному хімічному впливі, а також відсутності вживання фолієвої кислоти під час вагітності. Використання вальпроату матір’ю під час вагітності пов’язане зі значно вищими рівнями випадків ASD, а внутрішньоутробний вплив вальпроату використовували для розробки моделей аутизму в щурів. Вплив вальпроату приводить до гіпометилювання ДНК в ключових нейророзвиткових процесах, які були згладжені фолієвою кислотою in vitro. Інші хімічні речовини, такі як важкі метали, етиловий спирт, пестициди, фталати, поліхлоровані біфеноли та повітряне забруднення, також показали вплив на нейророзвиток та збільшення ризику ASD. Ці органічні токсини спричиняють окислювальний стрес, а важкі метали руйнують транссульфурацію, зв’язуючись з глутатіоном, головним регулятором окисно-відновного гомеостазу. Крім того, глутатіон є важливим регулятором у внутрішньоклітинному перетворенні метилкобаламіну (вітамін В12), важливого кофактора для метіонінсинтази та шляху ТС. Два незалежних дослідження пов’язували споживання фолієвої кислоти під час вагітності зі зменшеним ризиком народження дитини з ASD. Цей захисний ефект зазвичай приписують участі ФОМ у ранньому епігенетичному регулюванні нейророзвитку та формуванні невральної трубки.
Представлена робота використовує ці передові моделі та статистичні аналітичні інструменти для вивчення даних метаболітів шляху ФОМ/ТС у нейротипових учасників (NEU) та тих, хто перебуває на спектрі аутизму (ASD), а також їхніх братів і сестер (SIB).
Зв’язок дисфункції ФОМ/ТС з ASD вимагав відокремлення або розділення на групи ASD, SIB і NEU на основі метаболітів ФОМ/ТС. Результат розділення ASD, NEU та SIB, представлений на мал. 2, показує невелике збільшення перекриття групи учасників з ASD у порівнянні з результатами між ASD і NEU.
Малюнок 2.
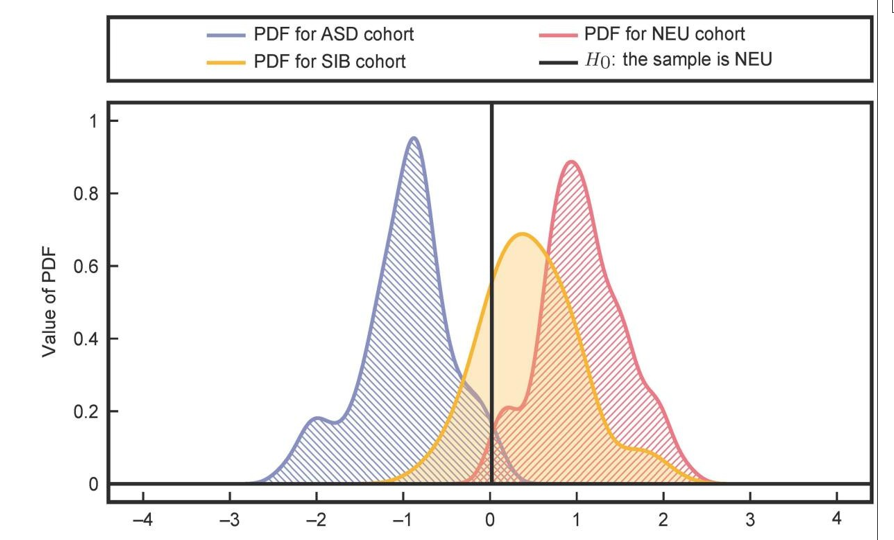
Більше того результати для SIB (сіблінгів) показують значно більше перекриття з NEU (нейротиповими), ніж ASD. Ці результати підтверджують гіпотезу, запропоновану Джеймсом та ін., що брати і сестри учасників на спектрі мають профілі метаболітів ФОМ/ТС, значно більш схожі з їх нейротиповими колегами, ніж їхні брати та сестри, хоча генетично вони, ймовірно, ближчі до своїх братів і сестер, ніж учасники в групі нейротипового контролю.
Хоча дисфункція ФОМ/ТС, ймовірно, не повністю розкриває етіологію ASD, цей біохімічний аналіз наближається до точності, необхідної для клінічного діагностичного інструменту.
Рівень повторності захворюваності серед братів і сестер на ASD оцінюється від 6.9% до 18.7%, і багато братів і сестер функціонують поведінково і/або пізнавально на проміжному рівні між групами ASD та NEU або виявляють риси, характерні для ASD. Отже, розташування групи SIB між групами ASD та NEU, хоч і набагато ближче до групи NEU, узгоджується з більш широкою науковою літературою з психометричного аналізу братів і сестер людей з ASD.
Розвиткові педіатри, психологи та інші фахівці ефективно можуть використовувати велику кількість інформації, наданої психометричними інструментами, для діагностики та оцінки пацієнтів з ASD. Однак ці тести рідко можуть діагностувати дітей віком до двох років, оскільки вони ґрунтуються виключно на поведінковій оцінці. Оскільки загалом визнається, що раніша діагностика може призвести до сприятливіших результатів у подальшому, ідентифікація біомаркерів, які можна використовувати разом із психометричними вимірами, може бути важливою для діагностики ASD. Більше того, ідентифікація цих біомаркерів може сприяти розумінню цих складних порушень, що відкриває значний потенціал для розробки стратегій втручання, спрямованих на нормалізацію цих біомаркерів у майбутньому. Отже як стверджує дослідження розглянуті в ньому біохімічні маркери є клінічно значущі при діагностиці аутичного спектру і дозволяють діагностувати аутичний спектр або можливе виникнення його в ранньому дитячому віці.
*В статті використаний матеріал дослідження «Classification and adaptive behavior prediction of children with autism spectrum disorder based upon multivariate data analysis of markers of oxidative stress and DNA methylation» Daniel P. Howsmon, Uwe Kruger , Stepan Melnyk , S. Jill James , Juergen Hahn, PLOS Computational Biology | DOI:10.1371/journal.pcbi.1005385 March 16, 2017.


0 коментарів